国家医薬品監督管理局は、医薬品査察情報の公開により注力し、査察業務の透明度を高めるために、2017年における国レベル医薬品登録関係生産現場査察、医薬品GMP追跡査察、医薬品抜打ち査察、輸入医薬品海外生産現場査察、医薬品流通査察、国際医薬品GMP観察査察などの実施状況と結果をまとめ、統計と分析を行った。2018年6月8日に、「2017年医薬品査察報告書」(中国語版と英語版)を発表した。
別添:1、「2017年医薬品査察報告書」(中国語版)
2、「2017年医薬品査察報告書」(英語版)
2017年医薬品査察報告書(抜粋)(和訳)
2017年、元国家食品医薬品監督管理総局は医薬品登録関係生産現場査察、ジェネリック医薬品一致性評価関係現場査察、医薬品GMP追跡査察、抜打ち査察、輸入医薬品海外生産現場査察、流通査察および国際観察検査など、合計751回を実施した。
2017年実施済み各種医薬品査察一覧表
|
査察種別 |
査察企業数/品目数 |
派遣査察チーム数 |
派遣人数 |
|
医薬品登録関係生産現場査察 |
52 |
47 |
168 |
|
ジェネリック医薬品一致性評価関係現場査察 |
12 |
8 |
38 |
|
医薬品GMP追跡査察 |
428 |
296 |
1234 |
|
医薬品抜打ち査察 |
57 |
55 |
183 |
|
輸入医薬品海外生産現場査察 |
51 |
41 |
148 |
|
医薬品流通査察 |
67 |
62 |
202 |
|
国際観察査察 |
84 |
84 |
92 |
|
合計 |
751 |
593 |
2065 |
輸入医薬品海外生産現場査察について
一、査察基本状況
2017年、元国家食品医薬品監督管理総局は合計41査察チームと148名の査察員を派遣し、51品目の輸入医薬品に対する海外生産現場査察を完了した。
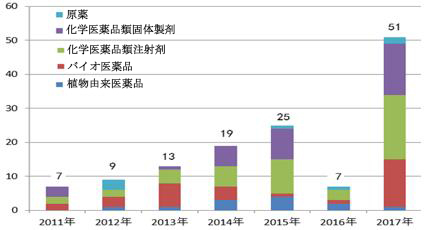
図4-1 2011-2017年海外査察実施件数
2017年、海外査察実施品目が比較的に多く、特に化学医薬品類製剤に対する更なる査察に注力した。そのうち、化学医薬品(注射剤、固体製剤、スプレー型粉薬、原薬などを含む。)が36品目、ワクチン、血液製品と治療用バイオ医薬品が14品目、植物由来医薬品が1品目だった。また、海外査察が実施された医薬品は生産、再登録の申請と補充申請の段階にある医薬品、および通常の手順で輸入し、販売されている医薬品を含む。主にヨーロッパ、北米から輸入されたもので、インドなどから輸入されたものに対する査察の件数も増加傾向がある。
二、発覚された主要問題
現場査察が実施された51品目のうち、9品目が医薬品GMP要求事項に適合せず、もしくは不合格という結論になり、各状況(上市前審査または上市済み)によって処置された。現場査察が実施されなかった8品目のうち、企業によるリスク制御措置をとったのが6品目で、残りが来年査察実施と計画された。
査察で発覚された欠陥が合計665項目で、そのうち、深刻欠陥が27項目、主要欠陥が140項目だった。問題点は主に品質制御と保証、書類管理、無菌薬品管理などに集中している。深刻欠陥は主に生産手順不一致、重大変更報告遅延、登録申請資料の信憑性問題、工場の施設、設備と生産操作行為などが製品の汚染と混淆リスクを有効的に軽減できないこと、不良品制御不能などだった。
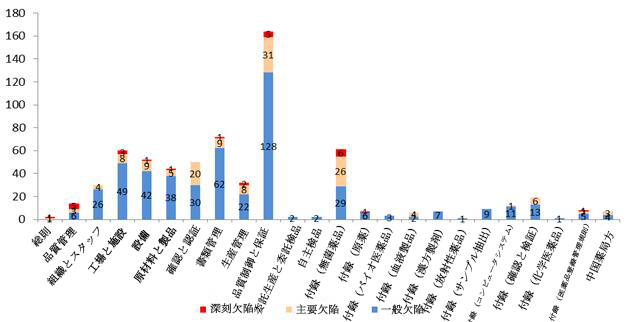
図4-2 2017年海外査察で発覚された欠陥の分布
(出所:国家医薬品監督管理局サイト2018-06-08)



 ホーム
ホーム 最新情報
最新情報 機構紹介
機構紹介 国際交流
国際交流 サイトについて
サイトについて