为加强药品注册申报资料的管理,确保申报资料的安全和有效利用,药品审评中心于4月启动了注册申报资料的内部电子提交前期各项准备工作,现相关工初步落实,自2013年6月13日起正式启动药品注册申报资料的内部电子提交试点工作。敬请广大注册申请人积极关注。内部电子提交系统的操作手册、相关事宜说明,见附件。
在该项工作试点的初期,中心将仅接受到中心内部进行的电子提交操作。待试点结束后,将在申请人之窗栏目中试点实施申报资料的电子提交。
该项工作是今年审评中心推出的服务于审评、提高审评管理水平的一项全新工作,目前处于试点阶段,欢迎广大注册申请人对我们工作提出意见与建议。
业务相关咨询电话:010-68585566-101至106 ,信息技术相关咨询电话:010-68585566-481、482,或通过网站信息反馈栏目进行邮件提交。
附件一:关于《药审中心将试点开展药品注册申报资料电子递交工作》相关事宜说明
药品审评中心于2013年4月18日发布了《药审中心将试点开展药品注册申报资料电子提交工作》的新闻,明确指出为提升药品注册申报资料的管理水平,强化申报资料的安全、环保和有效利用,提高药品技术审评的质量和效率,药审中心将试点开展药品注册申报资料电子递交工作。近期相关准备工作已经进入尾声,现就本项工作涉及的相关事宜,以问答形式予以公布,请广大申请人认真阅读,后续相关进展我中心还将以新闻形式陆续公示,敬请关注。
一、什么是内部电子提交?
注册申请人的注册申请被中心受理后,通过我中心办公区现场指定的计算机设备提交与该申请相关的全部申报资料电子版文件的过程叫做内部电子提交。
二、为什么要采用内部电子提交?
1.借鉴国际上关于药品注册申报资料电子化管理的经验,提升药品注册申报资料的管理水平。
2.强化申报资料的安全、环保和有效利用,同时解决纸质资料占用空间过大,不利于存放的问题。
3.提高药品技术审评的质量和效率,可以使您申报品种的全部相关信息快捷、准确地被技术审评所用,节约审评时间,缩短药品研发周期。
三、内部电子提交和网站电子提交的区别是什么?
内部电子提交的资料为全部申报资料的电子文件,而外网网站电子提交的只是部分申报资料:如质量标准、药品使用说明书、包装标签、工艺资料和药学、药理毒理和临床试验综述等资料(WORD文档)等。如申请人对所申报的品种进行了内部电子提交,网站的电子提交可以不重复提交。
四、内部电子提交有都有哪些安全保障?
1.内部电子提交的资料要求为PDF格式文件,所以提交的资料内容不可篡改。
2.电子资料进入中心系统后,中心的电子安全系统将对申请人提交的电子资料进行安全加密处理,同时严格按照品种的审评权限,在一定的时间范围内供审评人员使用。
3.电子提交的用户必须为中心申请人之窗实名制注册用户,确保进行电子提交企业身份的可靠性。
4.对于申请人的电子提交操作、审评人员的阅读与利用过程,系统都将对操作时间,操作人,操作过程等信息做记录。
五、如何进行内部电子提交?
企业准备齐全电子提交资料范围和内容规定的全部资料,携带电子资料到中心办公区,使用注册的申请人之窗账号登录电子资料提交系统,提交全部资料。
具体的操作手册及安全注意事项将于近期通过网站予以公布,提请广大申请人关注。
六、内部电子提交的相关要求有哪些?
1.内部电子提交的资料格式必须为标准PDF格式,且必须是清晰版本。
2.现场内网电子提交系统的登录用户,必须为我中心CDE网站申请人之窗注册用户,方可登录CDE内部电子提交系统,进行电子资料提交。
3.注册申请人需一次性上传全部文件资料,且在提交之后,不允许删除和重新上传文件。所以请提交人员准备完整的相关资料,准确的提交相关资料。
4.因技术审评过程中,审评人员需与提交文档的联系人就相关事宜进行沟通,务请在电子提交具体操作创建相关品种提交文档时填写准确的联系人和联系手机等信息,以便我中心与您及时联系沟通。
七、内部电子提交资料的范围和内容是什么?
本次电子提交暂时只接受如下几类范围:
1.IND:中心受理时间为2012年12月1日至今的品种。
2.NDA和验证性临床:中心受理时间为2011年6月1日至今的品种。
注:本次工作,以化药为试点,ANDA、补充申请、进口再注册暂不接受电子提交。
针对上述范围,电子递交的内容详见附件:CTD格式申报资料目录、化学药品申报资料项目(附件2格式)。
八、其他说明
如您还不是《申请人之窗》认证用户,我们也提供现场进行验证的服务。注册申请人必须先在中心外登录CDE网站进行注册,中心内不提供注册。现场验证只对提交资料进行实名验证,以激活账号。同时现场验证可能存在企业排队等待验证,当天无法验证完成等不确定因素,所以除特殊情况以外,建议企业尽量不要进行现场验证。
现场验证的流程:
1.提供办理实名身份验证所需全部的材料供审核,材料具体内容如下:
1)《注册账号申请表》(网上填报打印);
2)《组织机构代码证》复印件;
3)《营业执照(副本)》或其他批准成立证照复印件;
4)法定代表人有效身份证件的复印件;
5)经办人身份证的复印件;
以上所有资料必须加盖企业公章(一份)。
2.审核通过后,注册用户被激活,即可使用注册账号登录电子提交系统,进行电子提交操作。
3.咨询和联系方式
联系电话:010-68585566-481、482。
通讯地址:北京市海淀区复兴路甲1号
邮编:100038
您也可以通过CDE网站“信息反馈”(链接)栏目及时与我们联系和反馈
附件二、药品注册申报资料内部电子提交操作手册
一、登录
将存有电子资料的移动存储设备插到电脑主机上。在电脑正常识别之后,双击桌面的电子提交系统的链接图标,进入药品审评中心电子提交系统登录界面。
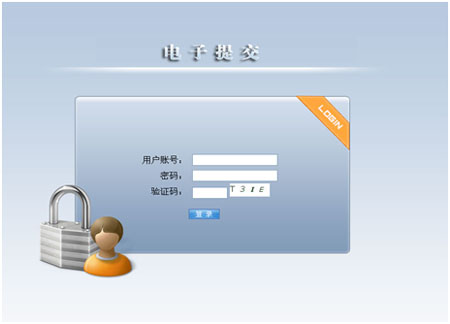
在界面对话框内输入用户名和口令,点击“登录”后,进入到下一步界面。
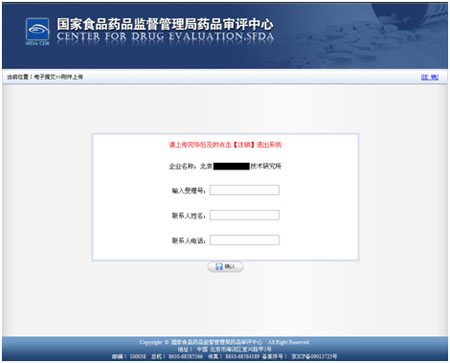
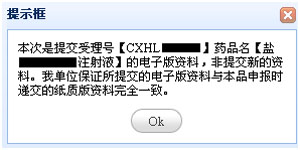
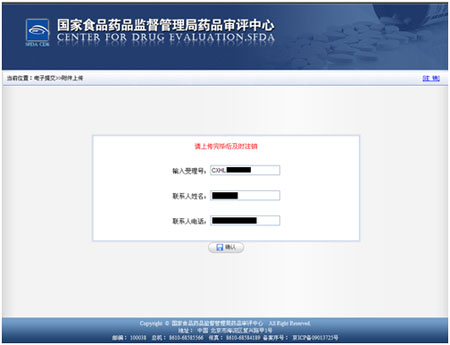
输入欲进行电子提交药品的受理号、联系人姓名(联系人应负责该品种的注册事宜)以及联系方式。然后点击“确认”按钮,进入电子提交界面,在弹出的一致性说明的提示框中点击“确定”。
二、提交操作
选择电子提交的申报资料类别,即化药申报资料,CTD原料药申报资料,CTD制剂申报资料。
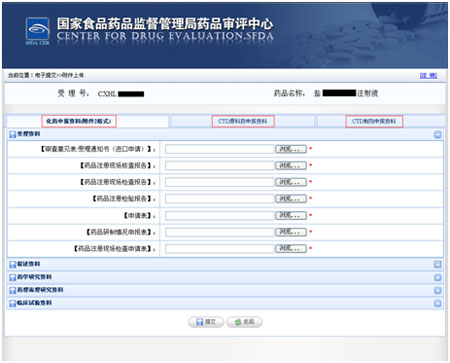
选择申报资料类别后选择提交资料的具体类别,
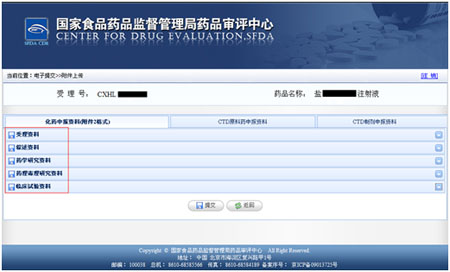
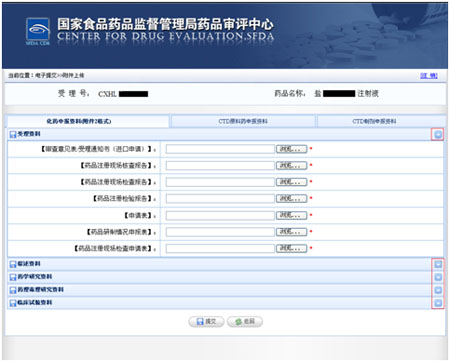
点击“浏览”按钮,弹出文件选择框,从您携带的存储设备中,选择企业欲提交的申报资料,按名称进行上传。

由于提交之后不允许用户进行修改和删除操作,所以企业在提交资料时,请务必认真核对提交项目名称和提交的文件是否正确对应。
在欲提交条目的内容全部选择完成之后,点击提交按钮。
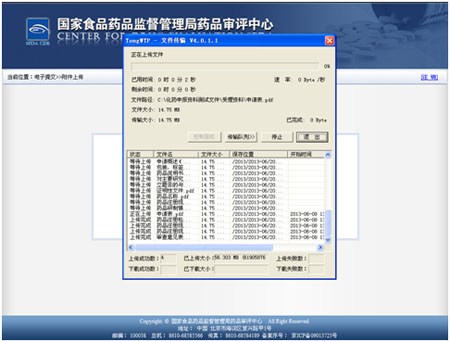
在文件全部传输成功以后,提示上传完成 。
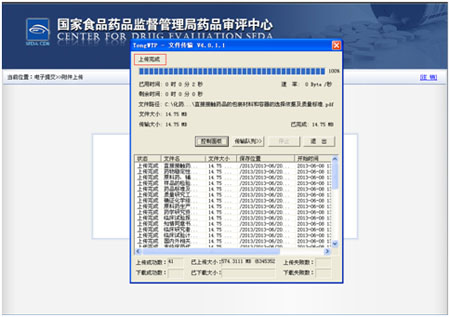
点击弹出框的退出按钮,完成提交操作。
您可以点击注销按钮 ,注销本次提交操作。注销后,将返回登录界面。
附申报资料文件名要求如下:
企业提交的申报资料文件名的长度不应超过20字符(包括中,英文),且不可以包括特殊符号。申报资料的文件名不必和提交的条目名相同,只要方便您的提交操作即可,系统会按提交的条目生成对应规则的文件名,与您申报资料的文件名无关。
人力资源与信息部
2013年6月9日
附件三、CTD格式申报资料目录、化学药品申报资料项目(附件二格式)
一、原料药CTD格式申报资料目录
管理信息资料:
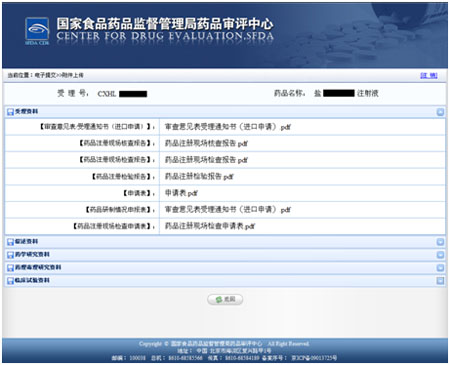
1.审查意见表/受理通知书(进口申请);
2.药品注册现场核查报告;
3.药品注册现场检查报告;
4.药品注册检验报告
5.申请表;
6.药品研制情况申报表;
7.药品注册现场检查申请表
综述资料:
1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
7.申请概述(仅针对特殊审批程序)
8.单独立卷(仅针对特殊审批程序)
信息汇总表:
信息汇总表资料
药学资料:
1.基本信息(3.2.S.1)
2 生产信息(3.2.S.2)
3.特性鉴定(3.2.S.3 )
4.原料药的质量控制(3.2.S.4)
5.对照品(3.2.S.5)
6.包装材料和容器(3.2.S.6)
7.稳定性(3.2.S.7)
药理毒理研究资料:
16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
临床试验资料:
28.国内外相关的临床试验资料综述。
29.临床试验计划及研究方案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
二、制剂CTD格式申报资料电子提交目录
管理信息资料:
1.审查意见表/受理通知书(进口申请);
2.药品注册现场核查报告;
3.药品注册现场检查报告;
4.药品注册检验报告
5.申请表;
6.药品研制情况申报表;
7.药品注册现场检查申请表
综述资料:
1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
7.申请概述(仅针对特殊审批程序)
8.单独立卷(仅针对特殊审批程序)
信息汇总表:
信息汇总表资料
药学资料
1.剂型及产品组成(3.2.P.1)
2.产品开发(3.2.P.2)
3.生产(3.2.P.3)
4.原辅料的控制(3.2.P.4)
5.制剂的质量控制(3.2.P.5 )
6.对照品(3.2.P.6)
7.稳定性(3.2.P.7)
药理毒理研究资料
16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
临床试验资料
28.国内外相关的临床试验资料综述。
29.临床试验计划及研究方案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告
三、化学药品申报资料项目(附件2格式)
管理信息资料:
1.审查意见表/受理通知书(进口申请);
2.药品注册现场核查报告;
3.药品注册现场检查报告;
4.药品注册检验报告
5.申请表;
6.药品研制情况申报表;
7.药品注册现场检查申请表
综述资料(文件夹名)
1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
7.申请概述(仅针对特殊审批程序)
8.单独立卷(仅针对特殊审批程序)
药学研究资料:
7.药学研究资料综述。
8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。
9.确证化学结构或者组份的试验资料及文献资料。
10.质量研究工作的试验资料及文献资料。
11.药品标准及起草说明,并提供标准品或者对照品。
12.样品的检验报告书。
13.原料药、辅料的来源及质量标准、检验报告书。
14.药物稳定性研究的试验资料及文献资料。
15.直接接触药品的包装材料和容器的选择依据及质量标准。
药理毒理研究资料:
16.药理毒理研究资料综述。
17.主要药效学试验资料及文献资料。
18.一般药理学的试验资料及文献资料。
19.急性毒性试验资料及文献资料。
20.长期毒性试验资料及文献资料。
21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。
22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。
23.致突变试验资料及文献资料。
24.生殖毒性试验资料及文献资料。
25.致癌试验资料及文献资料。
26.依赖性试验资料及文献资料。
27.非临床药代动力学试验资料及文献资料。
临床试验资料:
28.国内外相关的临床试验资料综述。
29.临床试验计划及研究方案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
(摘自:CDE网站 2013-06-13)



 首页
首页 最新动态
最新动态 机构简介
机构简介 国际交流
国际交流 关于我们
关于我们 京公网安备 11010802027110号
京公网安备 11010802027110号